
生物制药是制药行业近年来发展最快的子行业之一,全球市场规模预计将会从2016年的2020亿美元上升到2022年的3260亿美元,年复合增速8.3%。我国市场规模由2012年的627亿元,增长到2016年的1527亿元,年复合增长率达到24.9%。
Frost & Sullivan预计2016-2021年中国生物药将保持16.4%的年复合增长率,到2021年达到3269亿元的市场规模,国内生物药将成为医药行业最具前景的投资机会。
一、抗体药物研发发达国家投入占销售的15%,我国不足3%
9月23日,在中国医药企业家科学家投资家大会上,中国科学院院士、原四川大学副校长魏于全以“中国生物技术药物研发与投资机会”为题介绍了全球基础科学技术和药物研发的热点方向以及我国在新药研发上的具体进展。
比如肿瘤免疫治疗受到高度关注。2013年12月20日出版的美国《科学》杂志将癌症免疫治疗列为2013年度“十大科学突破”之首;基因治疗被2009年Science杂志评选的全球十大科学进展之一,近年一些药物已经在某些难治之症取得疗效并上市;CAR-T细胞疗法对白血病等血液肿瘤取得了巨大的突破,但是从针对实体瘤的临床试验结果看,CAR-T细胞对实体瘤的疗效并不显著。
虽然全球抗体药物市场不断扩大,但我国抗体药物发展还面临一些问题,包括抗体药物数量少,目前仅批准上市了7个抗体药物;技术创新能力不足;研发投入力度不够,发达国家研发投入占销售的15%,我国不足3%;产业化进程缓慢,产学研脱节,规模小力量分散等。
二、2016年,全球TOP10畅销药,生物药占8席,市场份额已超2000亿美金
从过去几年全球药物销售排行榜中可以看出,销量前10的药物中,生物药的比例逐年上升。2016年,8种为生物大分子药。抗体药为生物药的“王牌”,全球单抗销售额从1997年的3.1亿美元增长到2015年的916亿美元,年复合增速达34.9%。
2016年中国单抗销售额约91亿元,占比不足中国药品市场的1%,远低于全球约9%的市场占比。2017年36个药品通过价格谈判进入医保目录,其中12个为生物药(6个为抗体药)。
对于未来市场,Evaluate Pharma预测生物药将会继续维持强势的市场地位,预计生物药的市场份额将会从2016年的25%(2020 亿美元)上升到2022年的30%(3260亿美元)。
全球领先的医药研发公司对生物大分子药的关注日益增加,仅全球最大的18个制药公司的生物药在研品种就超过了900种。生物药研发资源及资金的投入、技术的不断进步以及对疾病的认识不断提高,促使制药公司可不断研发出具有卓越疗效及安全性的创新生物药。

三、国内生物药发展迅速,2021年市场规模或达3270亿元
在医疗保健支出增加、研发能力增强、政府政策积极变革及资本投资增加的推动下,过去数年,中国生物药市场正处于快速发展阶段,增长速度超越全球市场,预期未来将继续强劲增长。根据Frost & Sullivan 报道,中国生物药的市场规模由2012年的627亿元人民币增长至2016年的1527亿元人民币,年复合增长率为24.9%。
预计2016年至2021年会以16.4%的年复合增长率增长,于2021年达到3269亿元人民币的市场规模,为中国生物药参与者带来庞大机遇。
四、美股生物药公司历史投资回报丰厚
1995年至2017年,NBI(纳斯达克生物技术指数)的涨幅为1875.8%,远超过同期标准普尔500指数的涨幅(426.2%)。在过去22年中的13年里,NBI(纳斯达克生物技术指数)涨幅超过标准普尔500指数,在过去18年中有11年超过了XLV*(标准普尔医疗ETF)。
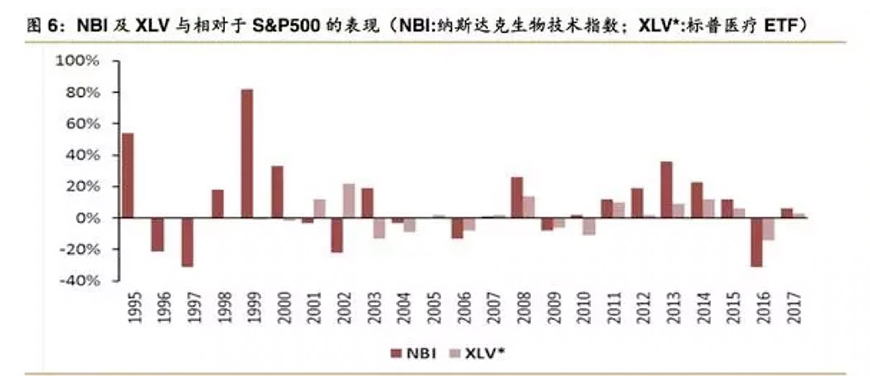
1998年至2000年,生物技术股表现明显超出标准普尔500,其原因主要在于人类基因组计划(HGP)开启了资本市场对生物技术股的第二次热情追捧。
五、投资国内生物药,海外估值要素借鉴
整个生物药研发流程包括临床前研发,I-III 期临床试验,市场进入准许,产品定价及销售,以及通过知识产权保护研发成果等部分。以目前最成熟、规模最大的美国市场为例,该行业的估值波动因素主要围绕在研发管线,政府监管,市场销售及并购四个方面。

(1)研发管线
药物研发周期长,风险高。Evaluate Pharma最新报告数据显示海外药企研发一种新药需要40亿美金,研发周期长达8-10年。产品的安全有效性、公司的创新能力、在研项目的数量、产权保护的完备性、生物类似药的问世期限等因素都会影响公司研发管线的估值。
(2)政府监管
在市场竞争下,生物技术公司必须在临床试验结果有效的同时确保符合政府监管要求。药品的上市审批速度及成功率影响着生物医药公司的价值实现。在已有的临床试验成果下,公司向监管机构提交上市申请,倘若申请未通过则重新进行药物评估直到符合规定。
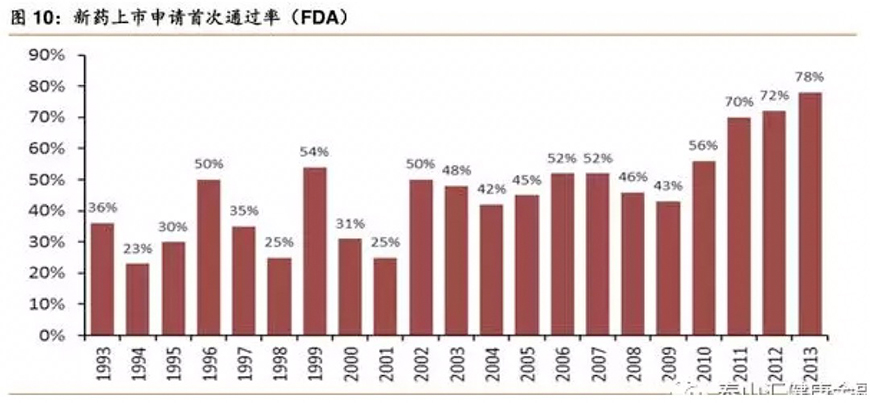
新药首次通过率并不是一成不变的,从20世纪90年代以来,美国药品上市申请通过率显著提高,主要源于FDA的新政以及公司与FDA间的有效沟通。由此我们可以推断,生物技术公司的研发实力和技术工艺、产品质量等都在不断提高,研发出来的产品能够通过FDA严格的审批审查制度。同时,我们也认为监管机构加快新药上市的审批速度是充分考虑市场需求的结果,新药快速上市一方面能够促进企业的发展,另一方面也能让更多的患者尽早接受治疗。
(3)产品销售
投资者需要考虑市场销量变化趋势、药品议价能力以及未来竞争药物上市等因素。强的市场销售能力有助于产品抢占大块市场,公司可以形成一定的垄断能力,从而巩固市场地位,由此也能够提高药品议价能力。但是未来竞争药物的上市必然会对公司造成冲击,新的竞争者可能导致药品降价和侵占市场份额。为此,我们认为投资者要充分考虑该产品能在市场上持续多长时间。
(4)并购
成熟大公司是否积极在外寻求企业发展? 新兴小公司是否有被并购的机会? 成熟大公司作为收购方之所以大量收购中小型生物医药公司,主要系:一方面可以提高营业收入,另一方面是为完善研发管线。
六、投资国内生物药的利好与挑战
(1)利好
1)患者刚需:肿瘤为代表的恶性疾病是生物药的主要适应症,患者对于有效药物 的需求强烈;
2)渗透率提升:生物药增速虽然快,但是以抗体药为代表的新 一代生物药的渗透率仍然很低,潜在市场巨大;
3)进口替代:原研进口药物价格昂贵,性价比极高的国产生物类似药和 me-too 药上市,将为更多的患者 带来治疗的机会,有望实现进口替代;
4)海外市场:生物药研发是国内与国基础数据际最为接近的领域之一,随着国家政策和制药企业的国际化,生物药“出海”的趋势明显。
(2)挑战
生物药:分子大、结构复杂、研发生产壁垒高。生物大分子药与传统化学药相比,最显著的是它们的分子量差别较大:传统化学药大都为小分子,通常分子量<1000 Da,如经典小分子药物阿司匹林的分子量为 180 Da;而生物大分子药大多为蛋白质,其分子量巨大,通常>5000 Da,蛋白质空间结构复杂,以单抗药物为例,其分子量已经达到了150-160kDa。
生物药不仅分子量大,结构也比化学药更复杂,因此其研发和生产难度均高于传统化学药。此外,不同于传统化学药,生物药的仿制难度也很大,尤其是对于单抗类药物来说,仿制过程几乎相当于一次重新研发。
著名跨国药企诺华旗下的仿制药子公司山德士认为:一种典型的化学仿制药的仿制成本为 200-300万美元,而生物仿制药的成本则高达 7500 万美元-2.5 亿美元。因此生物大分子药的专利过期之后,由于仿制难度大、成本高,仿制药对原研药的冲击没有传统化学药那样强烈。
总体来看,生物大分子药,尤其是抗体药,相比传统化学药最突出的优点就在于靶向性高,选择性好,因此疗效确切、副作用小。不过,生物大分子药相比传统化药也有一些缺点,比如膜透过性差(不易进入细胞,很难突破血脑屏障)、部分具有免疫原性等。
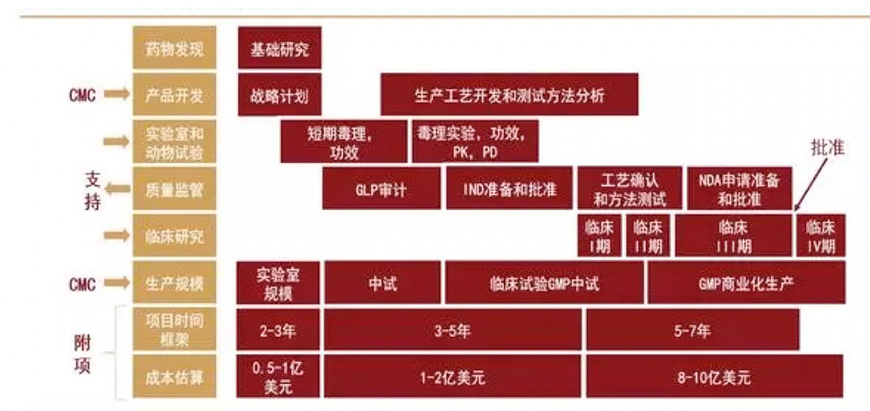
生物药研发与生产:高技术壁垒,成本与质量控制核心。生物药研发生产主要包括药物发现、临床前研究、临床试验和商业化生产等阶段。从药物发现开始,到临床研究申请(IND)前,大概需要 3-6 年,期间要完成临床前研究,包括工艺开发、技术转移和制造生产三个步骤。IND 审核批准通过后,可以进行临床试验,临床试验一般至少需要进行I、II、III三期,这个阶段需要6-7年,在临床试验成功后可向 FDA提交生物制品上市许可申请(BLA)。
FDA受理申请文件后,需要进行生物制品上市许可申请批准前检查(PAI),审核通过后,药品可以开始生产上市,这一阶段大概需要0.5-2年。生物药研发整个流程下来平均需要消耗 9.5-15年的时间,其时间成本、人力物力的投入都是巨大的。
生物类似药:不完全相同,但安全性和有效性相似。由于制造工艺和分子本身的特点,生物大分子药很难做到和原研药结构和功能完全相同,只能尽可能做到相似,因此被称为生物类似药(biosimilar)。欧盟、美国、中国和 WHO 分别给出了生物类似药的定义,尽管描述不完全相同,但核心思想一致,即生物类似药需与原研尽可能相似,有差异的地方不会影响其安全性和有效性。
七、Me-too类新药:国内另一个极具潜力的研发方向
生物类似药在价格和成功率等方面具有优势,但生物类似药需要面临一个时间等待的问题,原研药专利不到期,类似药无法上市,或者是冒着极大的侵权风险上市。而创新药的研制对各方面的要求都很高,需要强大的研发能力,充裕的资金供应,及能承受高失败风险的能力。而介于两者之间的一个很好选择就是Me-too药。

Me-too药是指为了规避已上市药品的专利权,通过对已上市药品进行结构改造或修饰,获得等同疗效的专利新药。Me-too药平衡了创新药和仿制药的特点,具有较高的研发性价比,数据显示,1986-2009年,FDA批准的614个新分子实体,大部分都是旧药修饰获得的Me-too药。
随着免疫治疗时代的到来,自2014年第一个PD-1抑制剂上市以来,以免疫检测点为靶点的抗体药开始崭露头角。目前,已有2款PD-1,3款PD-L1,1款CTLA-4为靶点的抗体药上市。虽然Opdivo是全球第二个上市的PD-1单抗,但其2016年的销售额已超过45亿美元,Tecentriq在2016年5月才获批第一个适应症膀胱癌,10月份获批第二个适应症非小细胞肺癌,上市半年的销售额已达到1.57亿美元,说明了这些药扩张能力极强,市场空间巨大。

八、CAR-T生物药,能对肿瘤细胞产生长期的特异性免疫作用
CAR-T细胞疗法为近年来最具颠覆性的新兴生物技术之一,全称是Chimeric Antigen Receptor T-Cell Immunotherapy,即嵌合抗原受体T细胞,这是一个出现了很多年但近几年才被改良使用到临床上的新型细胞疗法。和普通免疫细胞治疗类似,它的基本原理就是利用病人自身的免疫细胞来清除癌细胞,但是具有更高的肿瘤免疫特异性,能对肿瘤细胞产生长期的特异性免疫作用。
CAR-T为生物药(细胞治疗作为新兴的生物技术),正成为癌症免疫疗法生力军。2017年8月28日,全球知名医药公司吉利德科学宣布以119亿美元重金收购细胞疗法领军企业Kite Pharma,极大地体现了包括CAR-T在内的细胞疗法在治疗癌症方面的价值。2017年8月30日,美国FDA宣布批准全球首款CAR-T药物(Kymriah)上市,标志着人类抗癌进入新纪元。